척수성 근위축증
흔히 SMA로 잘 알려진 척수성 근위축증은 유전성 질환군입니다. 뇌와 척수인 중추 신경계(CNS)와 신체의 다른 모든 신경을 포함하는 말초 신경계(PNS) 모두에 영향을 미칩니다. 일반적으로 아동이 나이가 들수록 근 쇠약이 증가하면서 진행되는 질환입니다. 쇠약과 위축(근육 소모)은 팔다리가 아닌 신체 중심부 쪽으로 더 두드러집니다. SMA는 보통 신체의 양쪽에서 대칭성을 보입니다.
SMA에서 특히 영향을 받는 부위는 앞뿔(중심관 옆의 회색질)에 있는 척수의 운동 신경입니다. 이에 따라 뇌에서 신체로 전달되는 메시지는 방해를 받습니다. 자발적으로 움직일 수 있도록 골격근을 사용하려고 해도 움직임에 대한 메시지를 이행할 수 없습니다. 신체 근육은 신경으로부터 메시지를 받지 못하기 때문에 근육은 시간이 지나면서 위축되고 수축됩니다. 특히 얼굴, 혀, 목, 팔, 가슴, 다리의 움직임이 영향을 받게 됩니다. 이에 따라 호흡, 삼키기, 말하기, 걷기 등의 기능에 영향을 줍니다.

SMA의 영향을 받지 않는 신체 기능은 학습, 사회적 기술 등의 정신 기능입니다. 감각 신경은 영향을 받지 않기 때문에 신체의 감각이나 느낌이 온전히 유지됩니다. 시력과 청력은 영향을 받지 않습니다. 장과 방광 기능에도 미치는 영향은 없습니다.
유전적 특징
SMA의 가장 일반적인 원인은 돌연변이나 유전자 누락으로, 이로 인해 유전병으로 발현하게 됩니다. SMN은 생존에 필요한 체내 단백질입니다. 결핍 시 선택적 운동 뉴런 손실을 초래하기 때문입니다. 영향을 받는 유전자(SMA의 원인)의 이름은 염색체 5q에 위치한 생존 운동 뉴런 유전자 1(SMN1)입니다. 이 유전자는 운동 뉴런(신체의 움직임을 일으키는 신경)의 건강과 기능을 유지하는 일을 담당합니다. SMN2 유전자는 신체에 SMN1 유전자를 만들라는 지시를 내립니다. SMN1이 결여되고 SMN2가 부족하면 SMN이 생성될 수 없습니다. SMN1 유전자가 부족한 개인의 경우 SMA가 발생하게 되지만, SMN1이 없는 일부 개인은 SMN2를 사용하여 SMN을 생성할 수 있습니다.
SMA가 발현하려면 개인은 양쪽 부모로부터 열성 유전자(비우성)를 물려받아야 합니다. 한쪽 부모로부터 하나의 열성 유전자만 물려받는 경우 질병으로 이어지지는 않아도, SMA의 보인자가 됩니다. 유전적 요인이 명확하지 않은 경우는 드뭅니다.
SMA의 기대 수명에 관한 많은 질문이 있습니다. 전통적으로 낮은 유형의 SMA는 기대 수명이 더 낮습니다. 가장 높은 유형 4는 일반 사람들과 동일한 기대 수명을 갖습니다. 그러나 SMA를 개선하기 위한 새로운 치료법이 개발되면서 기대 수명이 향상하고 있습니다. 아울러 연구자들은 SMA의 호흡, 이동성, 기타 합병증을 개선하기 위한 옵션을 계속 늘려가고 있습니다.
SMA의 유형
SMA의 5개 유형은 최상의 운동 기능을 기반으로 합니다. SMA의 분류 시스템은 1991년 근이영양증 협회(MDA)에서 제시하였습니다. 중증도의 정도는 유형에 따라 다릅니다. 유형은 여러 범주에 걸쳐 있을 수 있습니다. SMA 환자 중 약 25%만이 한 가지 유형으로 명확히 분류될 수 있습니다. 이 ‘유형’ 분류 시스템이 사용되는 경우를 흔히 접할 수 있습니다.
기존 SMA 분류 시스템
| SMA 유형 | 진단/발병 연령 | 임상 징후 | 능력 |
| SMA 유형 0 | 출생 전 | · 태아의 움직임 감소 · 반사 반응이 부족하거나 없음 · 안면 마비 · 심장 중격 결손 · 관절 구축 및 골격 문제 · 근육 단일 수축 · 삼키거나 먹는 데 어려움 · 호흡 부전 | 호흡 지원이 필요함 |
| SMA 유형 1 (베르드니히-호프만병) | 0~6개월 | · 근육 긴장 저하(개구리 다리 자세) · 머리를 잘 가누지 못함 · 반사 반응이 감소했거나 무반응 · 늑간근(갈비뼈 사이의 근육)의 힘이 부족하여 배호흡을 함(횡격막은 여전히 기능함) · 구강 운동 약화로 인한 흡인 위험 · 정신 활동에는 영향이 없음 | 독립적으로 구르거나 앉을 수 없음 |
| SMA 유형 2 | 18개월 미만 | · 대체로 다리에 점진적인 쇠약이 나타남(팔은 그다지 심하지 않음) · 긴장 저하(반사 반응 없음) · 척주측만증 구축, 턱 경직 등 근육 약화로 인한 뼈 합병증 · 구속성 폐질환 · 정신 활동에는 영향이 없음 | 앉을 수 있지만, 서거나 걸을 수는 없음 |
| SMA 유형 3 (쿠겔버그-벨렌더병) | 18개월 이상 하위 유형: 3a 만 18개월~3세 3b 만 3세 이후 | · 팔보다 다리의 쇠약이 더 심함 · 호흡근 쇠약 또는 척주측만증이 매우 경미하거나 전혀 없음 · 달리기, 계단 오르기, 일어서려는 시도 시 어려움이 있음 · 정신 활동에는 영향이 없음 · 기대 수명에는 영향을 주지 않음 | 걸을 수 있으나 걷기 능력이 지연될 수 있음 |
| SMA 유형 4 | 만 21세 이상 또는 성인 | · 발병 사례 5% · 성인기에 시작됨. 만 30세쯤에 발병하는 경우가 많으나, 더 이르거나 늦을 수도 있음 · 경도에서 중등도의 다리 쇠약 · 정신 활동에는 영향이 없음 · 기대 수명에는 영향을 주지 않음 | 독립적으로 걷거나 이동 보조 장치를 사용하여 걸을 수 있음 |
| 염색체 5(SMN1 또는 SMN 단백질)와 관련 없는 SMA | 다양함 | · 중증도에 따라 다름 · 신체 중심부에서 더 멀리 떨어진 근육을 포함할 수도 있음 | 다양함 |
현재 SMA 분류 시스템
SMA는 시간이 지나면서 변화를 보이는 건강 문제입니다. 일부 환자는 위와 같이 분류되는 반면, 기능적 능력에 따라 한 유형에서 다른 유형으로 이동하는 사람도 있습니다. 변화는 개인에 따라 기능의 획득 또는 상실로 나타날 수 있습니다. 이에 따라 진단 당시의 기능보다는 현재의 기능 수준을 나타내고자 한층 더 실용적인 분류 체계가 개발되었습니다. 이 분류 시스템은 세 가지 범주로 구분되며, 더 많은 연구가 수행됨에 따라 하위 범주가 추가되고 있습니다. 분류는 앉기 불가능(Nonsitters), 앉기 가능(Sitters), 걷기 가능(Walkers)입니다. 어느 한 범주에 완벽하게 들어맞는 사람은 없으며 범주는 변경이 잦습니다.
| 범주 | 유형 분류 | 특징 |
| 앉기 불가능(Nonsitters) | 대부분 유형 1 | · 호흡 및 식사에 어려움이 있음 · 종 모양의 가슴 변형 · 혀의 근다발수축 · 고관절을 구부리지 못함, 머리가 뒤로 처지는 현상 |
| 앉기 가능(Sitters) | 대부분 유형 2 및 3 | · 앉을 수 있으나 걷지는 못함 · 팔보다 다리에 근 쇠약이 더 심함 · 관절 구축, 턱 강직이 나타나며, 척추측만증이 자주 발생함 · 대부분 호흡하고 삼키는 데 문제는 없으나, 늑간근 쇠약으로 구속성 폐질환 및 호흡 기능 부전이 발생할 수 있음 · SMA는 만 5세에서 15세 사이(특히 사춘기)에 진행될 수 있음 |
| 걷기 가능(Walkers) | 유형 2 또는 4 | · 보행 능력을 달성했거나 유지하고 있는 환자 · 팔의 쇠약에 비해 다리 기능이 떨어짐 · 보통 호흡을 하거나 삼키는 데 어려움이 없지만, 평생 걷기와 호흡이 매우 느린 속도로 약간 감소할 수 있음 · 이른 시기에 앉기 능력을 달성한 환자의 95%는 나이가 만 18개월이 되기 전까지 걸을 수 있음 · 늦은 시기에 앉기 능력을 달성한 환자의 50%는 나이가 만 18개월이 되기 전까지 걸을 수 있음 · 기대 수명은 일반 사람들과 동일함 |
| 성인 발병 | 유형 4 | · 다리 근육에 불편함이나 통증 등의 증상을 보일 수 있음 · 다리가 쇠약해져 걷기 능력을 유지하려면 부목이나 고정기가 필요할 수 있음 · 보통 삼키고 호흡하는 데 영향을 주지 않음 |
증상 및 진단
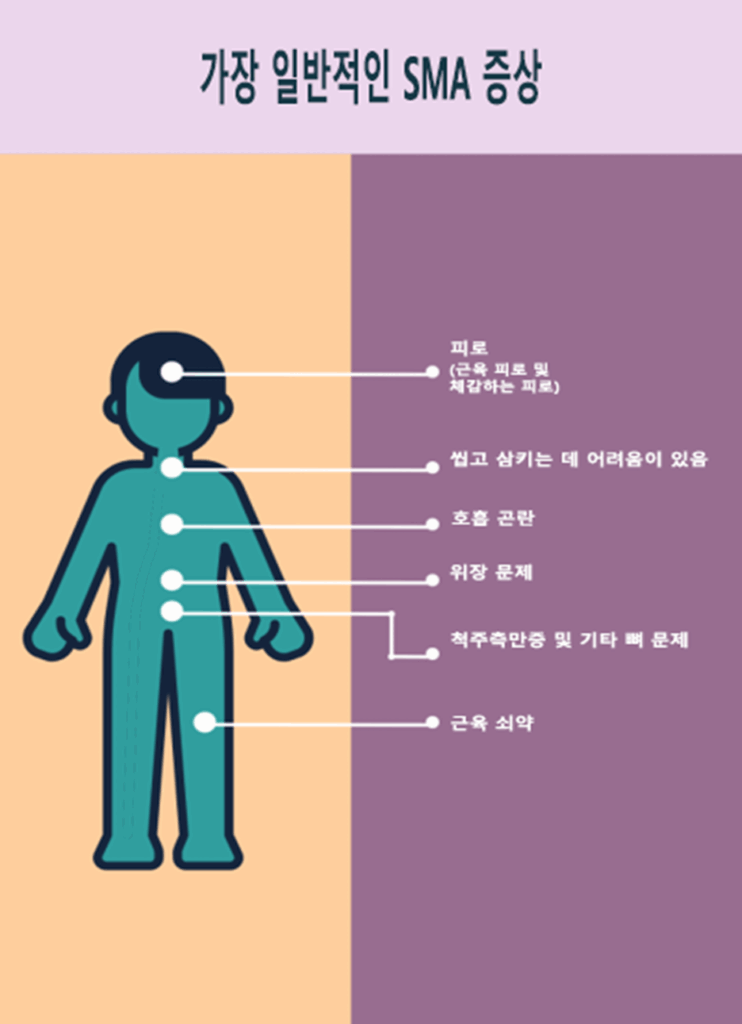
근 쇠약은 일반적으로 SMA의 첫 번째 증상입니다. 근 쇠약이 중증인 경우, 특히 신체 중심부 쪽으로 쇠약이 더 심하고 팔다리의 쇠약은 덜한 경우, 진단은 매우 명확합니다. 경미한 쇠약은 SMA 진단으로 직접 이어지지 않을 수 있습니다.
가장 확실한 검사는 유전자 검사로, 혈액 샘플을 사용하여 SMN1 및 SMN2 유전자의 돌연변이 또는 결손을 평가합니다. 또한 유전자 검사로 SMA 보인자인 사람을 찾아낼 수도 있습니다. 생물학적 남성과 생물학적 여성이 모두 보인자인 경우, 이들은 아동의 질병 위험을 줄이고자 개인적으로 기증자를 이용하기로 선택할 수도 있습니다. SMA 유전자 검사의 신뢰도는 95%입니다.
근전도 검사(EMG)는 근육의 전기 활동을 기록하여 근육 기능을 테스트하는 방법으로, 근육 수축과 이완을 비교하여 수행될 수 있습니다.
신경 전도 검사(NCS)는 EMG를 수행하면서 진행할 수 있습니다. 이 검사로 메시지를 전달하는 신경의 능력을 평가합니다.
이 그래픽은 SMA 뉴스 투데이(SMA News Today)의 허가를 받아 증쇄하였습니다.
근육 생검도 시행할 수 있습니다. 이 경우 극히 작은 근육 조각을 신체에서 제거하고 현미경으로 신경근육 질환을 나타내는 변화를 검사합니다.
생물표지자는 신체 또는 혈액의 특정 특징에서 나타나는 변화를 말하며, 질병을 알려줄 수 있습니다. SMN2 사본 수는 SMA 진단 및 중증도와 반비례합니다. 복합근육 활동전위(compound muscle action potentials), 운동 단위 추정, 전기적 저항 근운동 기록기(electrical impedance myography)로 이루어진 EMG 측정을 통해 SMA를 예측하고 적절한 치료용 약물을 추정합니다.
기타 혈액 검사에서는 SMN mRNA 및 단백질 수준 등을 측정하여 근육 파괴로 인한 노폐물을 확인합니다.
치료
특정 SMA 유형에는 약물을 사용할 수 있습니다.
누시네르센(제품명: 스핀라자)은 운동 뉴런을 유지하는 SMN2 스플라이싱의 조정을 통해 SMN 단백질의 생산을 늘립니다. 이 약물은 척추 주사를 통해 경막 내(척수와 척수를 포함하는 막 사이의 공간)로 전달됩니다. SMA 유형에 관계없이 아동과 성인이 이용할 수 있습니다.
오나셈노진아베파르보벡(제품명: 졸겐스마)는 SMN1 유전자 대체 요법입니다. SMN 단백질 생산은 아데노 관련 바이러스 혈청형을 사용하여 신경 세포에 들어가는 SMN1 유전자의 전달을 통해 개선됩니다. 이 바이러스는 비병원성입니다(자녀를 아프게 하지 않습니다). 이 바이러스는 세포로 쉽게 전달되는데, 안전성 덕분에 유전자 요법에 흔히 사용되는 방법입니다. 자세한 내용은 참조 섹션의 Pillay(2017년) 논문을 참조하시기 바랍니다. 영아 발병형 SMA가 있는 만 2세 미만의 아동에게 사용할 수 있습니다. 목표는 근육 운동, 기능, 생존을 향상하는 데 있습니다.
리스디플람(제품명: 에브리스디)은 SMN 단백질의 SMN3 유전자 발현을 자극하는 경구용 약물입니다. 만 2개월 이상의 아동에게 적합합니다.
SMN 유전자가 발견된 이후 SMA 치료법에 대한 연구 수는 풍부해졌습니다. 이에 따라 실험실 연구는 물론 임상(인간 대상) 연구도 진행 중 있습니다. 이러한 연구에는 SMN 단백질을 증가시키는 저분자 요법, SMN2 발현 증가를 위해 SMN2를 RNA 분자로 증가시키는 RNA 기반 요법, 누락된 SMN1 유전자를 대체하는 유전자 요법 등이 있습니다.
더 많은 연구가 빠르게 수행되고 있습니다. 미국 정부가 후원하는 새로운 임상 시험은 해당 웹사이트( https://clinicaltrials.gov/)를 확인하세요. SMA에 대한 개별 임상 시험 정보를 통해 연구자들의 견해에 관한 지식과 최신 임상 정보를 확인할 수 있습니다. 자녀의 건강을 위해 잘 대비하여 정확한 정보를 바탕으로 결정을 내릴 수 있도록 앞으로 예상되는 일을 파악해 두는 것이 중요합니다.
재활 요법
의료 전문가로 구성된 팀이 자녀의 진료를 담당하게 됩니다. 각 의료 전문가는 함께 협력하면서 환자의 요구 사항을 충족하고자 자신의 전문성을 적용합니다.
SMA가 의심되는 경우 유전학자나 신경과 의사가 상담을 통해 진단을 내립니다. 이러한 과정에서 감정적으로 지칠 수도 있습니다. 질병에 대한 정보를 아는 것은 자녀에게 제공되는 의학적 치료 옵션뿐만 아니라 삶의 질과 경험을 유지하는 방법을 이해하는 데 도움이 됩니다. 이 전문가는 자녀의 특정 요구 사항을 충족하고자 학교에서 필요한 개별화 교육 프로그램 또는 계획(IEP)에 기여하게 됩니다. 아울러 추가 가족계획에 도움을 줄 수도 있습니다. 이 치료 경로를 따르는 데 관심이 있다면 연구 요법에 대한 옵션을 설명해 줄 수도 있습니다.
정신 건강은 아동 및 가족에게 진료를 제공하는 심리학자를 통해 향상될 수 있습니다. 이 전문가는 자녀와 가족, 귀하에게 미치는 감정과 영향을 탐색하는 데 도움을 줍니다. 이 전문가도 역시 자녀의 특정 요구 사항을 충족하고자 학교에서 필요한 개별화 교육 프로그램(IEP)에 기여하게 됩니다.
전문 의료 서비스는 소아 신경근 장애 전문의, 소아 재활 의학 전문의, 또는 성인 재활 의학 전문의(연령 기준)를 통해 제공됩니다. 가활(새로운 기술 학습)과 재활(기술 재학습)을 장려하는 데 있어 자녀의 기능적 요구 사항을 돌보는 담당자가 바로 의사입니다. 이 의사는 치료, 장비, 치료법, 약물, 검사 등의 환자 관리를 구성하고 제공하는 면에서 의료 팀을 이끌 수 있습니다. 이 담당자는 도움이 될 연구와 새로운 치료법에 대해 알게 될 것입니다.
학교 교장, 교사, 교육 보조원과 같은 학교 교육자가 자녀에게 학습 지원을 제공해야 할 수도 있습니다. IEP를 사용하여 교직원을 참여시키는 것이 필수적입니다. SMA를 앓고 있는 경우 학습 능력은 영향을 받지 않지만, 호흡 및 이동 장비, 필기, 신체 활동, 식사 보조, 휴식 시간, 기타 문제에 대한 운동 요구 사항에는 적응 장비가 필요할 수 있습니다. IEP는 자녀의 요구 사항 및 학교 시스템이 이를 충족할 방법에 관하여 작성되고 문서화된 계획을 말합니다.
독립성을 최대로 높이는 장비는 물리 치료사, 작업 치료사, 언어 치료사가 권장해 줍니다. 신체 정렬을 유지하려면 자세를 잡아주는 장비가 필요합니다. 신체 정렬은 호흡, 골격계, 소화, 기타 문제를 지원해 줍니다. 장비에는 수면 시스템, 좌석, 휠체어, 보행기, 고정기, 목욕 장비 등이 있습니다.
척수성 근위축증의 치료법은 개인의 필요에 따라 다릅니다. 모든 환자에게 이 치료법이 전부 필요한 것은 아니지만, 그러한 치료법을 사용할 수 있음을 알고 있다면 건강 문제를 방지할 뿐만 아니라 건강을 개선하는 데도 도움이 됩니다.
호흡. 소아 또는 성인 호흡기내과 전문의 및 호흡 치료사가 필요에 따라 호흡 치료를 처방하고 조정합니다. 이러한 치료에는 기관 절개술이 필요할 수 있는 기계적 환기, 기관 절개술이 필요하지 않은 비침습적 기계적 환기, 흡입, 주입, 분무 요법, 유발폐활량 측정법과 같은 호흡 운동이 있습니다. 호흡기 감염은 더 쉽게 발생할 수 있습니다. 따라서 손 씻기, 호흡 운동, 안전한 거리 두기, 아픈 사람을 위한 격리 등을 실천하는 것이 중요합니다.
어떤 아동의 경우 휴식 중에 수면 무호흡증을 겪을 수 있습니다. 코골이, 킁킁거리는 콧소리, 호흡하지 않는 기간, 누워 있을 때 아침 두통과 같은 증상이 있는지 평가하고 모니터링해야 합니다. 호흡 문제는 심장 기능에 영향을 미치는 등 다른 건강 질환으로 이어질 수 있습니다.
구강 운동 기술은 언어병리학자의 지원을 통해 강화되고 향상될 수 있습니다. 이 전문가는 씹기, 삼키기, 언어 구음 개선에 도움을 줍니다. 삼키는 데 문제가 있는 경우 튜브 영양법과 같은 대체 식사 방법을 사용할 수 있습니다.
의사소통. 구강 운동 문제로 인해 의사소통이 중단될 수 있습니다. 이 경우 의사소통에 도움이 되는 장치를 사용할 수 있습니다. 이러한 장치는 약간의 손 움직임이 필요하거나 시선 추적 기술을 사용합니다.
영양. 씹고, 삼키고, 물리적으로 음식을 입으로 가져가는 것과 같은 식사 관련 문제가 있을 수도 있습니다. 적절한 영양이 제공되는지 확인하는 것이 필요합니다. 뼈 건강, 성장, 발달을 위해 칼로리 섭취량을 유지하거나 과식을 피하기가 까다로울 수 있습니다. 키, 몸무게, 체질량 지수(BMI)를 지속적으로 모니터링해야 합니다. 영양사는 자녀에게 가장 적합한 식단을 제공하는 데 도움을 줄 수 있습니다. 작업 치료사를 통해 적응 장비를 사용하는 방법을 배울 수 있습니다.
위장(GI) 문제. 씹기, 유동식, 운동 감소와 관련된 문제로 소화계가 느려질 수 있습니다. 이에 따라 위산 역류, 느린 위 내용 배출이나 장 기능으로 인한 포만감, 구토, 변비가 발생할 수 있습니다. 신진대사, 고혈압, 혈당, 지방 분해 등에 문제가 나타날 수 있습니다. 운동은 소화와 당 대사를 개선합니다. 기립 요법도 소화를 돕습니다. 위장병 전문의는 위장(GI) 문제를 전문으로 합니다. 위에서 언급한 문제에는 약물이 필요할 수 있습니다.
정형외과: 골격 문제는 SMA에서 특별히 관심을 두고 있습니다. 정형외과 의사(뼈 진료에 관해 교육을 받은 의료 전문가)는 뼈 문제를 치료하는 것은 물론 문제 예방에도 도움을 줍니다.
신체 관절을 스트레칭하는 것은 관절을 유연하게 유지하는 데 중요합니다. 스트레칭은 자녀가 독립적으로 몸을 움직일 수 없는 경우 제공할 수 있는 활동입니다. 구축과 경련을 방지하는 데 유용할 뿐만 아니라 신체에 전반적인 편안함을 가져다줍니다.
부목과 고정기는 신체를 제자리에 고정하고 관절을 안정시키며 움직임을 촉진하는 데 사용할 수 있습니다. 팔, 다리, 몸통, 목 등 자세 조정이 필요한 모든 곳에 사용할 수 있습니다. 일부 장비는 밤에만 착용하기도 합니다.
관절의 구축 또는 경직은 움직임이 어려운 SMA에서는 흔한 문제입니다. 유연성을 유지 또는 개선하고 근육 소모의 진행을 늦추며 움직임과 운동을 제공하고자 치료 및 교육이 자녀와 가족에게 제공됩니다. 구축은 정형외과 수술이나 순차적 석고고정(시간이 지남에 따라 구축이 교정됨)을 통해 줄어들 수 있습니다.
자세 잡기는 신체의 유지 및 기능에 중요합니다. 신체를 해부학적 정렬로 배치하는 장비를 사용하면 신체를 효과적이고 기능적인 형태로 유지할 수 있습니다. 스트레칭 운동, 부목, 순차적 석고고정이 도움이 될 수 있습니다.
기립대는 자녀가 자연스러운 높이에서 세상을 볼 수 있도록 직립 자세를 취하는 데 도움을 줍니다. 아울러 상황에 따라 개인 상호 작용을 향상하고, 뼈 발달을 개선하고, 자세와 소화에 도움을 줄 수 있습니다. 예상치 못한 합병증(특히 뼈 또는 혈관계통 관련)을 방지하려면 자녀가 이 활동을 신체적으로 할 수 있는 준비가 되어 있는지 반드시 담당 의료 전문가에게 문의하세요.
척주측만증(척추의 모양이 ‘S’자)과 척주후만증(척추가 ‘C’자 형태로 앞쪽으로 구부러짐)은 몸통 근육의 쇠약으로 인해 발생하는 문제입니다. 근육 불균형으로 척추뼈가 어긋나면 효과적으로 호흡하는 능력이 줄어들 수 있습니다. 척주측만증은 운동, 고정기, 외과적 개입(필요한 경우)을 통해 관리가 이루어집니다. 외과적 개입이 필요한 경우 척추의 견고한 안정화 또는 유연한 안정화 중에서 선택할 수 있습니다. 최신의 유연한 안정화 로드(rod)를 사용하면 수술에서 회복한 후 몸통을 약간 움직일 수 있습니다.
고관절 정렬은 앉아 있을 때뿐만 아니라 침대에 있을 때에도 중요한 요소입니다. 둔부 근육의 스트레칭뿐만 아니라 고관절이 바르게 정렬되어 있는지 확인하면 몸이 좋은 자세로 유지되어 고관절 구축, 오정렬(misalignment), 척주측만증 문제를 방지할 수 있습니다.
이동성과 운동은 모든 사람에게 매우 중요합니다. 몸은 몹시 움직이고 싶어 합니다. 운동은 호흡, 소화, 정신적 및 전반적인 건강에 유리합니다. 이동 장치(예: 휠체어, 보행기, 부목, 고정기)는 자녀가 주변 환경에서 움직일 수 있도록 지원해 줍니다. 이러한 장치는 자녀가 발달상 독립할 준비가 되었을 때 자신의 세계에서 독립성을 구축하도록 지원합니다. 치료를 통한 운동은 개인에 따라 다르게 처방됩니다. 운동을 위한 다른 옵션에는 운동 게임, 수중 치료, 장애인 스포츠, 신체 기능을 장려하는 모든 활동이 포함될 수 있습니다.
뼈 건강. 체중이 뼈에 가해지지 않으면 미네랄이 감소하여 뼈가 부러지기 쉽습니다. 이에 따라 뼈가 쉽게 골절되기도 합니다. 골감소증은 골밀도의 손실을 말하며, 골다공증으로 이어집니다. 골밀도 검사는 모든 연령대의 SMA 환자를 대상으로 매년 시행하여 골밀도를 조기에 파악하고 치료를 시작해야 합니다. 운동을 하고 기립대로 일어서 있으면 골밀도를 유지하는 데 유리하지만, 경우에 따라 더 심해져서 약물이 필요하기도 합니다.
고식적 치료 팀은 특별 교육을 받은 간호사를 포함한 개인 그룹으로 구성됩니다. 이들은 삶의 질 요구를 위한 의료 지원을 제공해 줍니다. 이 서비스는 생애 말기의 치료만을 위한 것이 아니라 지원을 통해 자녀와 귀하의 요구 사항이 충족되도록 보장합니다. SMA는 다양한 방향으로 발달할 수 있습니다. 이 그룹은 자녀의 필요가 어떻게 변하는지에 따라 자녀에게 치료 제공을 시작할 수도 있고 중단할 수도 있습니다.
역사
1891년 귀도 베르드니히(Guido Werdnig)가 두 명의 유아 형제에게서 SMA를 발견했을 때 이 질환이 의학 문헌에 처음으로 기술되었습니다. 1893~1900년에 요한 호프만(Johan Hoffmann)이 ‘척추근 위축(spinal muscle atrophy)’이라는 용어를 사용하면서 유아의 진행성 쇠약을 광범위하게 기술하였습니다. 베르드니히-호프만(Werdnig-Hoffmann)은 SMA 유형 1의 이름이 되었지만, 이들의 설명은 중간 수준의 사례를 다루고 있었습니다.
중증 사례는 1899년과 1903년에 나타났습니다. 걷고 설 수 있는 SMA 환자의 경미한 사례는 1950년대에 나타났습니다. 1991년 근이영양증 협회(Muscular Dystrophy Association)가 척수성 근위축증 국제 컨소시엄(International Consortium on Spinal Muscular Atrophy)에서 SMA의 3개 유형과 발병 연령을 기준으로 한 분류 체계를 지원하기 전까지는 유형 및 분류에 대한 논란이 있었습니다.
1995년이 되어서야 멜키(Melki) 연구소에서 SMA의 원인이 염색체 5Q13에 있는 SMN1 및 SMN2 유전자의 결손에 있음을 밝혔습니다. 이것은 극히 중요한 발견이었습니다. 이러한 발견 이전에는 SMA가 발생한 구체적인 이유가 알려지지 않아 치료법 개발도 불확실했기 때문입니다. 유전적 요인을 발견한 후 5년 이내에 동물 모델을 만들어 SMA를 연구하고 치료법 개발을 시작할 수 있었습니다.
2007년 왕(Wang)과 동료들은 성장에 따른 SMA 지침을 포함하여 SMA 환자 관리를 위한 최초의 임상 지침을 개발했습니다.
유전적 문제를 파악한 이후 국립 신경 질환 뇌졸중 연구소(National Institute of Neurological Disorders and Stroke)와 재단, 약리학자, 생명 공학자는 저분자 치료, RNA 치료, 유전자 요법 등을 사용하여 SMN1과 SMN2를 증가 또는 개선하는 치료법을 개발해 왔습니다. 다음 치료법을 사용했을 때 중요한 결과를 발견할 수 있었습니다.
- 2016년에 누시네르센(제품명: 스핀라자)이 모든 유형의 SMA용으로 FDA의 승인을 받았습니다.
- 2017년에는 SMN1 유전자 대체에 초점을 맞춘 오나셈노진아베파르보벡(제품명: 졸겐스마)이 FDA의 승인을 받았습니다.
- 2020년에 SMN 단백질의 SMN2 유전자 발현을 자극하는 리스디플람(제품명: 에브리스디)이 FDA의 승인을 받았습니다. 리스디플람은 SMA 치료를 위한 최초의 경구용 약물입니다.
더 많은 연구가 수행되고 임상 시험이 다양한 단계로 진행되면서 연구가 꾸준히 증가해 왔습니다. 아울러 많은 연구자들이 SMA 환자의 삶을 개선하는 데 기여했다는 사실을 기억하는 것이 중요합니다. 이들의 연구는 호흡, 약물, 척주측만증 치료, 기타 뼈 문제에 개선을 가져왔을 뿐만 아니라, 다른 많은 문제 가운데 삶의 질 문제에 중점을 두었습니다.
사실 및 수치
SMA는 유전적 변화로 인한 영아의 가장 흔한 사망 원인입니다.
6,000명의 아기 중 1명이 SMA를 가지고 태어납니다. 모든 연령대의 11,000명 중 1명이 SMA의 영향을 받습니다.
SMA의 유전적 이상을 갖고 있지만 해당 질환이 없는 사람은 54명 중 1명입니다.
SMA의 가장 흔한 유형은 베르드니히-호프만(Werdnig-Hoffmann) 병으로 전체 사례의 80%를 차지합니다. 쿠겔버그-벨렌더(Kugelberg-Welander) 병은 유아기에 진단되는 또 다른 유형입니다.
영아기 및 유아기에서 발생하는 SMA는 나중에 발현하는 경우에 비해 더 나쁜 결과를 보입니다.
리소스
척수성 근위축증에 대한 자세한 정보를 원하거나 특정 질문이 있다면 본 재단의 정보 전문가에게 평일(월요일~금요일) 동부 표준시 오전 7시~오전 12시(자정)에 수신자 부담 전화 800-539-7309로 문의하시기 바랍니다.

